Rewolucja na rynku wyrobów medycznych trwa!
Co zmieni nowa polska ustawa o wyrobach medycznych?
Przygotowaliśmy dla Państwa krótki przewodnik po zmianach, jakie niesie za sobą polska nowa ustawa o wyrobach medycznych. Dla lepszego zrozumienia rozpoczniemy od kluczowych dla tego tematu kwestii.
W 2017 roku przyjęto Rozporządzenie Parlamentu Europejskiego i Rady 2017/745 w sprawie wyrobów medycznych (MDR-Medical Device Regulation). Rozporządzenie miało obowiązywać od 2020 roku, jednak w obliczu pandemii wywołanej koronawirusem przesunięto jego stosowanie o rok.
Głównym celem MDR jest wprowadzenie jednolitych wspólnotowych ram regulacyjnych dla rynku wyrobów medycznych w Unii Europejskiej. Dzięki nowym przepisom łatwiejsza będzie identyfikacja wyrobów oraz nadzór nad podmiotami odpowiedzialnymi za ich wytwarzanie i dystrybucję. Nowe przepisy nakładają szereg obowiązków dla wytwórców oraz dystrybutorów wyrobów medycznych. Obowiązkowe będzie znakowanie w postaci kodów na etykietach i opakowaniach w zależności od klasy wyrobu medycznego.
Rozporządzenie MDR w zakresie oznakowania wprowadza dwie ważne kwestie:
- obowiązkowy zapis informujący, że dany produkt jest wyrobem medycznym lub konieczność zastosowania symbolu zharmonizowanego,
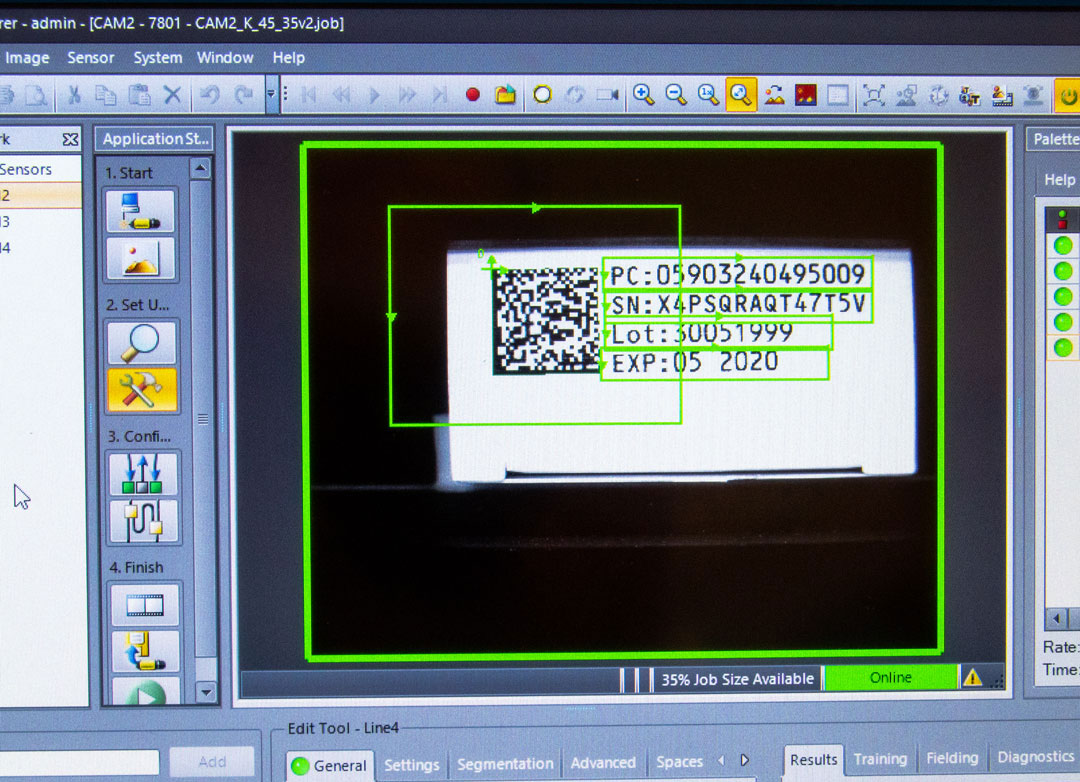
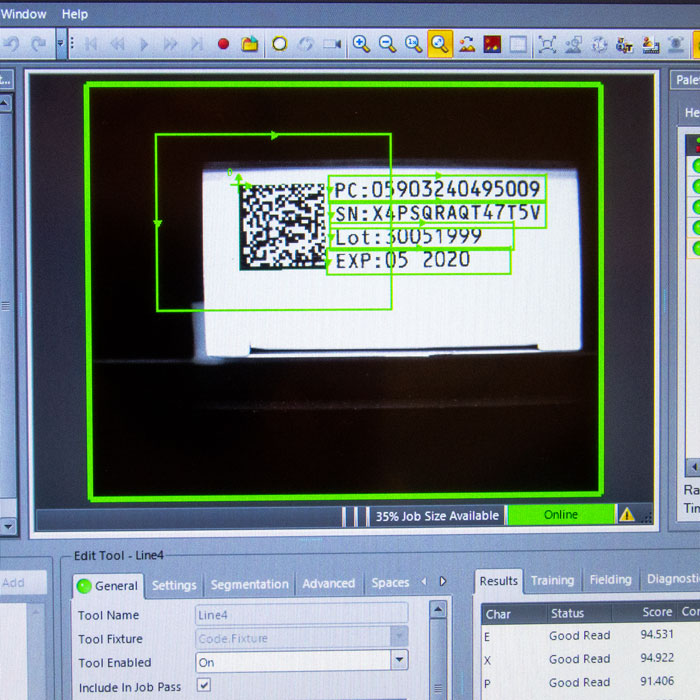
- umieszczanie na etykiecie wyrobu nośnika kodu UDI.
Umieszczenie kodu UDI na etykietach jest obligatoryjne dla wyrobów medycznych. Znakowanie kodem UDI podlegają wszystkie wyroby, za wyjątkiem tych na zamówienie oraz takich w fazie badań klinicznych. Ustawodawca przewidział jednak wprowadzenie okresów przejściowych dla nowych przepisów. Dla wyrobów klasy III do 26 maja 2021 roku, dla wyrobów klasy II a i II b do 26 maja 2023 roku. Producenci wyrobów klasy I mają obowiązek umieszczać kod UDI na oznakowaniu wyrobu od maja 2025 roku.
UDI ważnym elementem składowym MDR
UDI to skrót z języka angielskiego, oznacza Unique Device Identification, czyli Unikalną Identyfikacje Wyrobów Medycznych. Jest to system przeznaczony do właściwej identyfikacji wyrobów medycznych.
W wyniku wdrożenia UDI doprowadzimy w dłuższej perspektywie do zwiększenia bezpieczeństwa pacjentów i poprawy wydajności w łańcuchu dostaw w obszarze ochrony zdrowia. Dzięki systemowi możliwa będzie jednoznaczna identyfikacja urządzeń medycznych. Uzyskane dane pozwolą na ograniczenie wybranych błędów medycznych, skuteczniejsze monitorowanie działań niepożądanych oraz bardziej efektywne wycofywanie wadliwych wyrobów medycznych z łańcucha dostaw.
Przepisy dotyczące UDI zostały opracowane przez Amerykańską Agencję do spraw Żywności i Leków, Komisję Europejską, a także inne światowe organy regulacyjne. Ich celem jest zwiększenie bezpieczeństwa pacjentów, podniesienie jakości opieki zdrowotnej oraz usprawnienie procesów biznesowych z zakresu szeroko pojętej ochrony zdrowia. W realizacji tych zadań w wymiarze globalnym ma zadbać właśnie system UDI. Coraz więcej wyrobów medycznych będzie znakowanych w jednolity sposób.
Dostosowanie polskiego ustawodawstwa do unijnego rozporządzenia Co producenci powinni wiedzieć, żeby przygotować się do nowej rzeczywistości prawnej?
W kwietniu 2022 Prezydent Andrzej Duda podpisał ustawę o wyrobach medycznych, która ma dostosować polskie prawo do europejskiego rozporządzenia 2017/745. Nowa ustawa ma obowiązywać od 26 maja 2022 roku. Uporządkuje ona niejednoznaczne przepisy, jakie obowiązywały do tej pory w porządku prawnym w Polsce. Mieliśmy bowiem do czynienia z sytuacją, w której trzeba było bezpośrednio stosować rozporządzenie unijne przy niedostosowanej do aktualnej sytuacji ustawie o wyrobach medycznych z 2010 roku. Ustawa o wyrobach medycznych ma zapewnić właściwe stosowane ww. rozporządzenia oraz sprawne funkcjonowanie rynku wewnętrznego w obszarze wyrobów medycznych i wyrobów medycznych do diagnostyki in vitro. Zmiany dotyczą obowiązku przekazywania m.in. informacji i deklaracji zgodności, instrukcji użytkowania oraz oznakowania i materiałów promocyjnych wprowadzonych do obrotu na terenie Polski. Ten obowiązek ma dotyczyć wytwórców, autoryzowanych przedstawicieli, podmioty zestawiające wyroby medyczne czy podmioty sterylizujące systemy bądź zestawy zabiegowe.
Co jeszcze się zmieni? W znacznej części polski ustawodawca wykracza poza regulacje europejskich rozporządzeń. Wymusi to na międzynarodowych firmach dostosowanie się do polskiej specyfiki. W ustawie należy przede wszystkim zwrócić uwagę na:
- Nowe zasady prowadzenia reklamy i promocji wyrobów medycznych – bardzo ważna kwestia, ponieważ dotyczy zarówno dużych firm międzynarodowych, jak i małych jednoosobowych. Przepisy będą obowiązywać od stycznia 2023 roku. Reklama wyrobów medycznych będzie zdecydowanie trudniejsza. Na czym będą polegać zmiany? Nowa ustawa wprowadza zapis, że reklama kierowana do publicznej wiadomości będzie musiała być sformułowana w zrozumiały dla laika sposób. Nie będzie też już można wykorzystywać wizerunku osób wykonujących zawody medyczne, a osoby, które będą prezentować wyrób nie będą mogły sugerować takiego zawodu. Co ciekawe, z reklam mają zniknąć również bezpośrednie zawołania CTA (ang. Call to action) skierowane do dzieci. Ustawa wprowadza wysokie kary administracyjne za nieprzestrzeganie nowych przepisów, ale przewiduje również okresy przejściowe do czerwca 2023 roku. Zgodnie z Art. 55 niniejszej ustawy nie można reklamować wyrobów przeznaczonych do używania przez użytkowników innych niż laicy.
- Nowe kary administracyjne za nieprzestrzeganie przepisów ustawy i rozporządzeń – nowe przepisy zaskakują wysokością potencjalnych kar (od 2 mln PLN do nawet 5 mln PLN). Zaskakująca jest również rozpiętość tych regulacji. Przewiduje się kary za wprowadzenie do obrotu wyrobu niezgodnego z wymogami, ale również za brak zawarcia umowy regulującej zasady przechowywania dokumentacji technicznej wyrobu.
- Zmiana przepisów w zakresie podatku od towarów i usług – przewiduje możliwość stosowania obniżonej 8% stawki VAT na niemal wszystkie wyroby medyczne.
- Nowe wymagania w zakresie polskich wersji językowych – zasadniczo sprowadza się to do posiadania interfejsu w języku polskim.
Podsumowując, rewolucja na rynku wyrobów medycznych trwa. Wprowadzone zmiany znacząco wpłyną na rynek wyrobów medycznych. Według ekspertów większość polskich przepisów odbije się negatywnie na atrakcyjności rynku i otoczeniu biznesowym w Polsce. Niestety może się okazać, że część wyrobów medycznych zniknie z polskiego rynku, bo nie będą mogły sprostać nowym wymaganiom. Tym samym wartość rynku spadnie. Duże znaczenie będzie miało dobre przygotowanie do nowych regulacji. Szczególną uwagę należy zwrócić na takie aspekty jak: weryfikacja dotychczasowych działań reklamowych i właściwą komunikację zewnętrzną firmy. Konieczne jest dalsze oznakowanie wyrobów z uwzględnieniem polskiego interfejsu. Zaleca się również przeprowadzenie audytów pod kątem ryzyka prawnego związanego z karami pieniężnymi oraz optymalizację działalności pod kątem stawek podatku VAT – możliwość korzystania z obniżonej 8% stawki podatku VAT. W Prespack stale monitorujemy zmiany w przepisach prawnych. Dołożymy wszelkich starań, aby pomóc naszym obecnym i przyszłym Klientom właściwie je wdrożyć.